- ¿QUE ES LA TERMODINÁMICA EN FÍSICA?
- PREGUNTAS FRECUENTES SOBRE LA TERMODINÁMICA
- Termodinámica
- Calor y temperatura
- Diferencia entre calor y temperatura
- Equilibrio térmico
- Escalas termométricas absolutas
- Conductividad calorífica y capacidad térmica específica
- Leyes de la Termodinámica
- Teoría Cinética de los Gases
- Estructura de la materia (enfoque clásico)
- Temperatura según la Teoría Cinética de los Gases
- Temperatura según la Teoría cinética de los gases
- Ecuación de estado de los gases ideales
- Ecuación de estado de los gases ideales
¿QUE ES LA TERMODINÁMICA EN FÍSICA?
¿QUE ES LA TERMODINÁMICA EN FÍSICA?
PREGUNTAS FRECUENTES SOBRE LA TERMODINÁMICA
¿Qué es la termodinámica y para qué sirve?
¿Qué es la termodinámica y ejemplos?
¿Qué es la termodinámica resumen?
¿Qué estudia la termodinámica?
La termodinámica es el área de la Física que estudia la energía y entropía, teniendo fuertes y variadas conexiones con otras áreas de la Física; particularmente, con la mecánica, la física del estado sólido y la física no – lineal.
¿Cuáles son las 4 leyes de la termodinámica?
¿Cuántas leyes de la termodinámica son?
¿Quién fue el fundador de la termodinámica?
Termodinámica
APRENDE TODO SOBRE LA TERMODINÁMICA | CURSO ONLINE FÍSICA
Calor y temperatura
En ocasiones utilizamos los términos calor y temperatura para referirnos a lo mismo de forma errónea. Científicamente hablando el calor y la temperatura se encuentran relacionados entre si aunque representan conceptos diferentes.
La temperatura mide la energía térmica que contiene un cuerpo. Un cuerpo caliente tendrá una temperatura mayor que un cuerpo frío. Concretamente la temperatura mide la vibración o la energía interna de las partículas que componen ese cuerpo de forma que un cuerpo más caliente tendrá una temperatura mayor. Así pues podríamos definir temperatura como la medición de la actividad molecular del objeto.
Calor por otra parte es la transferencia de energía térmica de un cuerpo a otro de menor temperatura. El calor siempre fluye desde el cuerpo con mayor temperatura hacia el de menor temperatura y no deja de transferirse hasta que los dos cuerpos se igualan en temperatura y quedan en equilibrio.
Medición de la temperatura en grados Cº y Fº
El calor puede transmitirse de varias formas, por radiación, conducción o convección.
En la conducción se produce el intercambio de calor por contacto directo entre los dos cuerpos, las moléculas transmiten su energía al otro cuerpo hasta que alcanzan el equilibrio.
La convección se produce en los gases y en los líquidos y consiste en que los fluidos más calientes son más ligeros que los fríos por lo que tienden a subir mientras que los fríos bajan formando corrientes de convección.
La radiación es la propagación de la energía térmica sin que exista contacto entre los dos cuerpos. La radiación se produce en el espacio vacío y es como el Sol calienta la tierra.
Métodos de propagación del calor
Hay que reseñar que los cuerpos no contienen calor sino energía térmica, el calor es la transferencia de energía entre dos cuerpos.
El calor se mide en Julios en el Sistema Métrico Internacional aunque puede que la medida más conocida sean las calorías. Una caloría es la energía que hay que suministrar a un gramo de agua para aumentar un grado su temperatura, concretamente de 14,5º a 15,5º.
Es habitual ver en los alimentos etiquetas con la indicación de las kilocalorías (Kcal). Una kilocaloría, como su propio nombre indica, equivale a 1000 calorías.
Para actuar con eficacia ante un incendio y tomar las medidas necesarias para su extinción mediante los medios existentes en el local y poder erradicarlo, es muy importante conocer como el actúa el fuego y se transmite el calor del mismo hacia todos los materiales de su alrededor, propagándose.
Una vez que conocemos como se propaga el calor de un cuerpo a otro podemos aplicarlo a como se propagan los incendios. Un fuego se propagará de igual forma que el calor, por conducción, convección y radiación. Por lo tanto, conocer las formas en las que un incendio puede propagarse puede ser de vital importancia a la hora de sofocarlo.
APRENDE TODO SOBRE LA TERMODINÁMICA | CURSO ONLINE FÍSICA
Diferencia entre calor y temperatura
La diferencia entre calor y temperatura radica en que el calor se define como el movimiento o intercambio de energía entre cuerpos, mientras que la temperatura es la medida de la agitación de las moléculas de un cuerpo.
La relación entre calor y temperatura es que para que la temperatura de un cuerpo cambie debe haber una transferencia de calor.
| Calor | Temperatura | |
|---|---|---|
| Definición | Transferencia de energía de un cuerpo a otro. | Medida de la energía cinética de las moléculas de un material. |
| Unidades |
|
|
| Instrumento de medición | Calorímetro | Termómetro |
| Ejemplos | Una cuchara caliente transfiere calor al agua fría de una taza. |
|
APRENDE TODO SOBRE LA TERMODINÁMICA | CURSO ONLINE FÍSICA
Equilibrio térmico
Escalas termométricas absolutas
Existe dos tipos de escalas termométricas bastante conocidas: Las relativas y absolutas, con sus respectivas diferencias que las conoceremos a continuación.
Escalas relativas
Las escalas relativas son aquellas en las que el valor cero de su escala no corresponden al cero absoluto del agua, las cuales son:
- Celsius (ºC)
- Fahrenheit (ºF)
Escalas absolutas
Una escala de termométrica absoluta es aquella en la que el cero de dicha escala, coincide con el cero absoluto del agua y entre ellas tenemos:
- Kelvin (ºK)
- Rankine (ºR)
APRENDE TODO SOBRE LA TERMODINÁMICA | CURSO ONLINE FÍSICA
Conductividad calorífica y capacidad térmica específica
El calor se transfiere de 3 formas diferentes.
Conducción:
Es la forma en que el calor se conduce o propaga en los solidos, debido al choque de las moleculas del cuerpo sin que este modifique su forma.
ejemplo:
Cuando uno de los extremos de una varilla metalica se pone en contacto con fuego, despues de un timpo en el otro extremo habra calor. esto se debe a que sus moleculas del extremo opuesto al fuego vibran con mayor energia y parte de esa energia se transfiere a las moleculas cercanas las cuales a su vez, transfieren ese exceso de energia a las otras moleculas. Asi, la temperatura del cuerpo aumenta uniformemente y se distribuye en todo el cuerpo.
Conveccion:
El calor se propaga a través de un fluido.
Radiación:
El calor se transfiere a través de ondas electromagnéticas.
Caloría:
Cantidad de calor necesario para elevar en un grado centígrado la temperatura de un gramo de agua. el equivalente de calor en joules es 1 caloría =4.2 joules.
Capacidad calorífica:
Se define como la razón que existe entre la cantidad de calor que recibe un cuerpo y su incremento de temperatura.
C=Q/∆t
donde:
Q=cantidad de calor (cal)
∆t= incremento de temperatura (ºC)
C=capacidad calorífica (cal/ºc)
calor especifico:
es la razón que existe entre la capacidad calorífica de una sustancia y su masa. También se define como la cantidad de calor empleada para aumentar en un ºC la temperatura de un gramo de una sustancia.
agua——–1
hierro——.113
aluminio—-.217
cobre——-.093
hielo——–.050
mercurio—-.033
APRENDE TODO SOBRE LA TERMODINÁMICA | CURSO ONLINE FÍSICA
Leyes de la Termodinámica
Ley Cero de la termodinámica
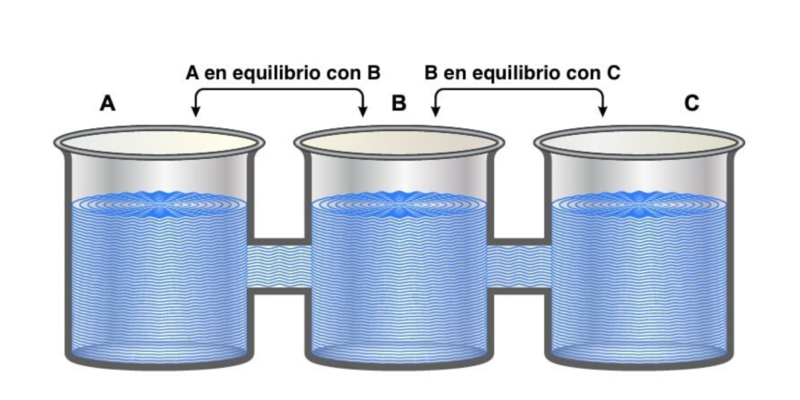
La “ley cero” es llamada así porque a pesar de haber sido la última en postularse, establece preceptos fundamentales para las otras tres.
Indica que “si dos sistemas están en equilibrio térmico de forma independiente con un tercer sistema, deben estar también en equilibrio térmico entre sí”.
Esto puede expresarse lógicamente como que si A = C y B = C, entonces A= B.
Primera Ley de la termodinámica
También conocida como la “Ley de la Conservación de la Energía”, establece que en cualquier sistema físico aislado, la cantidad total de energía será la misma a lo largo del tiempo, aunque pueda transformarse en otras formas de energía.
Dicho de otro modo: “en un sistema aislado, la energía no puede crearse ni destruirse, solo transformarse”.
Otra manera de enunciar esta ley es mediante la relación entre el calor (Q) que recibe o cede un sistema termodinámico, el trabajo hecho o recibido por él y su energía interna. Al suministrar una cantidad determinada de calor a un sistema, su energía interna (ΔU) será igual a la diferencia entre esa cantidad de calor y el trabajo (W) que hace el sistema sobre sus alrededores.
Es decir: Q = ΔU + W, o lo que es lo mismo: ΔU = Q – W.
Esta formulación establece que la diferencia entre la energía del sistema y el trabajo efectuado será desprendida del sistema como calor.
Segunda Ley de la termodinámica
Este segundo principio establece que “la cantidad de entropía en el universo tiende a incrementarse en el tiempo”, esto es, que el desorden de todos los sistemas incrementa hasta que hayan alcanzado el equilibrio.
Dicho de otro modo: dado el tiempo suficiente, todos los sistemas tienden al equilibrio, que es el estado de máximo desorden, máxima entropía.
Esta ley postula la irreversibilidad de los fenómenos físicos, e introduce la función de estado de entropía (S).
Así como la primera ley relaciona las distintas energías que intervienen en un proceso, la segunda ley impone restricciones a su dirección y un límite superior a la eficiencia de una máquina térmica. Esto quiere decir que ninguna máquina que convierte calor en trabajo puede hacerlo con 100% de eficiencia. Así, la segunda ley es importantísima para muchas aplicaciones de la vida cotidiana y para la industria.
Este principio también se formula clásicamente como que el cambio en la entropía (dS) será siempre igual o mayor a la transferencia de calor (Q), dividido por la temperatura (T) de la fuente que proporciona o absorbe ese calor: dS ≥ δQ / T
Tercera Ley de la termodinámica
Conocida también como el Postulado de Nerst, esta ley plantea que la entropía de un sistema llevado al cero absoluto es una constante definida:
- Al llegar al cero absoluto (0 K), los procesos de los sistemas físicos se detienen.
- Al llegar al cero absoluto (0 K), la entropía poseerá un valor mínimo constante.
Teoría Cinética de los Gases
La teoría cinética de los gases permite deducir las propiedades del gas ideal empleando un modelo en el que las moléculas del gas son esferas que cumplen las leyes de la mecánica clásica.
Las propiedades calculables mediante este modelo son: presión del gas, distribución de velocidades moleculares, velocidad molecular media, velocidad de colisión y distancia media entre colisiones. Estas propiedades permiten el estudio de la cinética de reacciones en fase gaseosa así como el flujo de fluidos y la transmisión de calor.
Fundamentos de la teoría cinético-molecular de los gases

La teoría cinética puede considerarse como una rama de la termodinámica estadística ya que deduce propiedades macroscópicas de la materia a partir de propiedades moleculares. Los principios en los que se fundamenta son los siguientes:
- Un gas está formado por un gran número de partículas esféricas cuyo tamaño es despreciable comparado con la distancia entre las partículas.
- Las moléculas se mueven en línea recta a gran velocidad y sólo interaccionan cuando colisionan. Los choques entre partículas y con las paredes del recipiente se consideran perfectamente elásticos, conservándose la energía cinética traslacional.
- La teoría cinética supone que las partículas obedecen las leyes de Newton. Esta suposición es incorrecta (las moléculas cumplen las leyes de la mecánica cuántica) y conduce a resultados incorrectos en la predicción de las capacidades caloríficas del gas, aunque da resultados aceptables en propiedades como presión o difusión.
Estructura de la materia (enfoque clásico)
La estructura de la materia, según el enfoque clásico, está constituida de electrones, protones y neutrones. En la Física clásica, la “materia” es aquello de lo que están hechos todos los objetos que constituyen el Universo visible. La materia se agrupa en moléculas y ésta a su vez es una agrupación de átomos. Los átomos se componen de partículas subatómicas:
- Electrones: partículas con carga eléctrica negativa.
- Protones: partículas con carga eléctrica positiva.
- Neutrones: partículas sin carga eléctrica (pero con movimiento magnético).
¿Qué es la materia y cuál es su estructura?
La materia es todo aquello de lo que está hecho el universo visible, incluidos nosotros mismos. Su estructura es la siguiente: los neutrones (con carga eléctrica neutra) se encuentran en el centro del átomo junto con los protones de carga positiva: a esto se le llama materia bariónica. Igualmente sabemos que los protones y neutrones no son partículas elementales, sino que se constituyen, a menor nivel, de partículas más pequeñas que llamamos quarks. Los electrones de carga negativa se encuentran girando al rededor del núcleo. El electrón, por otro lado, sí se le considera una partícula elemental y se le clasifica dentro del rango de materia fermiónica (junto con los fotones y los neutrinos), pero estos últimos conceptos están más cerca de la Física cuántica que de la física clásica.

En el enfoque clásico de la física, a las partículas subatómicas se les considera como pequeños corpúsculos de materia, como diminutas bolas de billar que interactúan entre si. Como se expone en el modelo atómico de Rutherford o en el modelo atómico de Bohr y otros modelos atomicos de la mecanica clásica. El enfoque moderno de la física cuántica ha rebelado lo carente y simplista que es este enfoque, pues hoy se conoce con certeza que la materia no solo se comporta como partícula, sino también como onda, a esto se le denomina Dualidad Onda-Partícula.
¿Cuál es la importancia de conocer la estructura de la materia?

Es importante conocer la estructura de la materia para ser capaces de hacer frente a las preguntas más grandes del Universo que plantea la ciencia de hoy en día; y aprender cada vez más sobre el inicio y la evolución del universo en que vivimos. Al mismo tiempo esto conduce a aumentar el conocimiento colectivo, a la innovación tecnológica y al bienestar de toda la humanidad a través de las generaciones.
Temperatura según la Teoría Cinética de los Gases
La teoría cinética de los gases es una teoría física y química que explica el comportamiento y propiedades microscópicas de los gases a partir de una descripción estadística de los procesos moleculares microscópicos.
Los principales postulados de la teoría cinética son los siguientes:
- El número de moléculas es grande y la separación media entre ellas es grande comparada con sus dimensiones. Por lo tanto, ocupan un volumen despreciable en comparación con el volumen del envase y se consideran masas puntuales.
- Las moléculas obedecen las leyes de Newton, pero individualmente se mueven en forma aleatoria, con diferentes velocidades cada una, pero con una velocidad promedio que no cambia con el tiempo.
- Las moléculas realizan choques elásticos entre sí, por lo tanto se conserva tanto el momento lineal como la energía cinética de las moléculas.
- Las fuerzas entre moléculas son despreciables, excepto durante el choque. Se considera que las fuerzas eléctricas o nucleares entre las moléculas son de corto alcance, por lo tanto solo se consideran las fuerzas impulsivas que surgen durante el choque.
- El gas es considerado puro, es decir todas las moléculas son idénticas.
- El gas se encuentra en equilibrio térmico con las paredes del envase.
Propiedad y definición
Son aquellas propiedades distintivas de las sustancias que se observan cuando reaccionan, es decir, cuando se rompen y/o se forman enlaces químicos entre los átomos, formándose con la misma materia sustancias nuevas distintas de las originales.
Las propiedades químicas se manifiestan en los procesos químicos (reacciones químicas), mientras que las propiedades propiamente llamadas propiedades físicas, se manifiestan en los procesos físicos, como el cambio de estado, la deformación, el desplazamiento, etc.
Ejemplos de propiedades químicas: – corrosividad de ácidos – poder calorífico o energía calórica – acidez – reactividad
Presión
En el marco de la teoría cinética la presión de un gas es explicada como el resultado macroscópico de las fuerzas implicadas por las colisiones de las moléculas del gas con las paredes del contenedor. La presión puede definirse por lo tanto haciendo referencia a las propiedades microscópicas del gas.
En general se cree que hay más presión si las partículas se encuentran en estado sólido, si se encuentran en estado líquido es mínima la distancia entre una y otra y por último si se encuentra en estado gaseoso se encuentran muy distantes.
En efecto, para un gas ideal con N moléculas, cada una de masa m y moviéndose con una velocidad aleatoria promedio o raíz cuadrada de la media aritmética de los cuadrados de las velocidades, en inglés «root mean square» vrms = v, contenido en un volumen cúbico V las partículas del gas impactan con las paredes del recipiente de una manera que puede calcularse de manera estadística intercambiando momento lineal con las paredes en cada choque y efectuando una fuerza neta por unidad de área que es la presión ejercida por el gas sobre la superficie sólida.
La presión puede calcularse como
P = ((N m v²)/3V) (gas ideal)
Este resultado es interesante y significativo no sólo por ofrecer una forma de calcular la presión de un gas sino porque relaciona una variable macroscópica observable, la presión, con la energía cinética promedio por molécula, 1/2 mv², que es una magnitud microscópica no observable directamente. Nótese que el producto de la presión por el volumen del recipiente es dos tercios de la energía cinética total de las moléculas de gas contenidas.
Temperatura según la Teoría cinética de los gases
Según la teoría cinética, la temperatura es una medida de la energía cinética media de los átomos y moléculas que constituyen un sistema. Dado que la energía cinética depende de la velocidad, podemos decir que la temperatura está relacionada con las velocidades medias de las moléculas del gas.
Hay varias escalas para medir la temperatura; las más conocidas y utilizadas son las escalas Celsius (ºC), Kelvin (K) y Fahrenheit (ºF). En este trabajo sólo utilizaremos las dos primeras.
Ecuación de estado de los gases ideales
La ley de gas ideal, también conocida como ecuación de gas general, es la ecuación de estado de un hipotético gas ideal. Es una buena aproximación al comportamiento de muchos gases bajo diferentes condiciones, sin embargo, tiene varias limitaciones. Es decir, describe un gas hipotético formado por partículas puntuales sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética).
PV = nRT
- P = presión
- V = volumen
- n = moles de gas
- R = constante universal de los gases ideales
- T = temperatura absoluta
Fue propuesta por primera vez por el Físico e Ingeniero francés Emile Clapeyron en 1834 como la combinación empírica de la ley de Boyle, la ley de Charles (ley de volumen), la ley de Avogadro y la ley de Gay-Lussac.
Ecuación de estado de los gases ideales
Para una misma masa gaseosa (por tanto, el número de moles (n) es constante; n=cte), podemos afirmar que existe una constante directamente proporcional a la presión y volumen del gas, e inversamente proporcional a su temperatura.

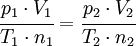

[…] 4.Dar click ▷ Termodinámica […]